
Práctica 3: Diagrama de Clapeyron y curva de presión de vapor saturado
- 1 | Introducción y fundamento teórico

- 2 | Materiales
- 3 | Realización
- 4 | Resultados y discusión
Introducción
El montaje experimental de la presente práctica permite estudiar mediante variaciones de presión y temperatura el diagrama de Clapeyron de un gas, mediante el registro de las diferentes isotermas. Nos permite por tanto estudiar tres áreas relevantes en las que se divide el diagrama pV de una sustancia: gas, líquido y coexistencia líquido-vapor.
Teoría
Los diagramas pV permiten representar de forma gráfica el comportamiento de una sustancia ante la variación de sus coordenadas termodinámicas. Dentro de los procesos que son de especial interés en estos diagramas cabe destacar la representación de los procesos que tienen lugar a temperatura constante, mediante las líneas llamadas isotermas.
Las isotermas para un gas ideal son hipérbolas, algo que es fácilmente demostrable teniendo en cuenta la ecuación de estado de las gases ideales. En la figura 1(a) se representan líneas isotermas para un gas ideal a varias temperaturas.
La ecuación de estado de los gases ideales es una muy buena aproximación al estudio de gases a altas temperaturas y bajas presiones. Sin embargo para otras situaciones, en especial aquellas que implican un cambio de fase, las sustancias no obedecen esta ecuación y el diagrama pV asociado, también llamado diagrama de Clapeyron es más complejo, como puede verse en la figura 1(b).
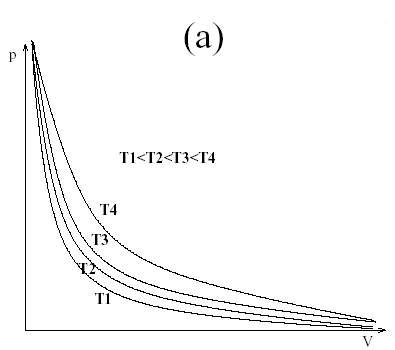
Distintas isotermas en un diagrama pV para gases ideales
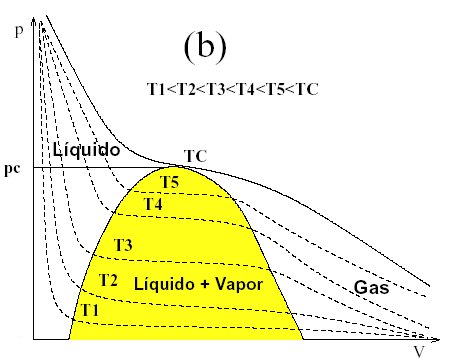
Distintas isotermas en un diagrama pV para gases no ideales. La zona amarilla representa la zona donde coexisten la fase líquida y gaseosa.
En concreto nos interesa el comportamiento de una sustancia cuando realiza una transición de fase pasando del estado líquido al gaseoso. A temperaturas bajo la llamada temperatura crítica (Tc) las isotermas tienen una gran pendiente para valores pequeños del volumen. Esta zona corresponde a la sustancia en estado líquido y refleja el hecho de que los líquidos son prácticamente incompresibles cuando se comparan con los gases.
A continuación de esta zona se encuentra otra, sombreada en el gráfico, en la que las isotermas son planas: la variación de volumen no implica cambio de presión. Para entrar en esta zona el sistema cruza -en negro en el diagrama de la figura 1(b)- la llamada curva de saturación del líquido y comienza la evaporación. En esta zona el incremento de volumen implica el paso de sustancia de fase líquida a gaseosa y viceversa: si reducimos el volumen parte del vapor presente se condensa, con lo que la presión se mantiene constante.
Si se aumenta el volumen hasta que todo el líquido pasa a fase gaseosa, en ese momento se abandona la zona de coexistencia entre fases, sombreada, y se entra en la zona de gas, atravesando la curva de saturación del vapor, donde el incremento de volumen implica disminución de la presión y viceversa.
Como puede verse en la figura 1(b), el volumen y la presión a la que ocurre el cambio de fase depende de la temperatura, esto es, de la isoterma en la que nos estemos moviendo. Como puede apreciarse en la gráfica, conforme aumenta la temperatura la coexistencia líquido-vapor tiene lugar a mayor presión y volumen, y cada vez tiene lugar durante un intervalo de volumen más pequeño. Existe una temperatura límite llamada temperatura crítica (Tc) cuya isoterma asociada muestra un punto de inflexión en el que tendría lugar la coexistencia entre fases y que corresponde al punto en el que se cortan las curvas de saturación del líquido y el vapor. A la presión a la que tiene lugar esta intersección se la llama presión crítica.
A temperaturas superiores a Tc las isotermas muestran un comportamiento similar al del gas ideal y la sustancia se encuentra en fase gaseosa para cualquier valor del volumen.
En esta práctica el alumno tomará las medidas necesarias para construir el diagrama de Clapeyron del hexafluoruro de azufre (SF6), cuya temperatura y presión críticas son, respectivamente, Tc=46ºC y pc = 37 bar.
Tras tomar datos para cinco diferentes temperaturas se representaría el diagrama de Clapeyron de esta sustancia así como la curva de presión del vapor saturado.








